Tema 4. Configuración electrónica

Inicio

Indicador de logro
Describe la organización y características representadas en la tabla periódica de los elementos.
1. Responda las siguientes preguntas. Luego, comparta sus respuestas en un grupo.
- ¿Cómo se organizan los electrones alrededor del núcleo del átomo?
- ¿Por qué los gases nobles o inertes no reaccionan?
- ¿Por qué los elementos que pertenecen a un mismo grupo tienen propiedades similares?
- ¿Cuándo es necesario configurar?
- Si es necesario hacer una configuración, ¿en qué se basa para realizarla?
Desarrollo
Nuevos aprendizajes

Configuración electrónica
Es el ordenamiento de los electrones dentro de la nube electrónica utilizando los números cuánticos. Se utiliza una notación en la cual se nombra cada orbital a través de:
El nivel de energía (número cuántico principal).
El tipo de orbital.
El número de electrones por orbital.
La configuración electrónica explica cómo los electrones se distribuyen entre los diversos orbitales en un átomo.
Los periodos de la tabla periódica representan los números cuánticos o niveles de energía. Los momentos angulares del número cuántico se definen según la ubicación de los elementos en la tabla periódica. El número de electrones por orbital se define según la posición que el elemento ocupe en la tabla periódica.
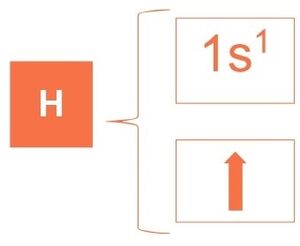
Por ejemplo: el hidrógeno se encuentra en el primer periodo de la tabla periódica, por lo cual su configuración electrónica es 1s1.
Los orbitales con igual nivel de energía (se refiere a orbitales con el mismo número cuántico n y el mismo número cuántico l) se llenan progresivamente de manera que siempre exista un mayor número de electrones desapareados; por ejemplo, si en los orbitales 2p se tiene que llenar con cuatro electrones, la forma correcta de hacerlo es:
Una vez que se ubican los primeros 3 electrones (color más oscuro), el cuarto electrón, se ubicaría en el orbital con m= -1 (color más claro).
Lo anterior, se resume de la siguiente forma: