Tema 6. Números de oxidación

Inicio

Indicador de logro
Explica la mecánica de formación de compuestos binarios y los nombra utilizando el sistema clásico o funcional.
1. Reflexione. ¿Qué partícula subatómica es indispensable en la formación de compuestos? ¿Por qué?
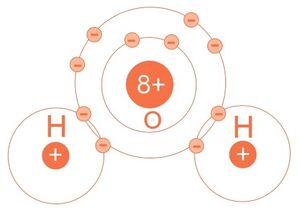
2. Presente el siguiente modelo atómico del agua (H2O).
3. Identifique la alternativa correcta para formar una molécula de agua.
Dos átomos de hidrógeno y el de oxígeno se unen compartiendo electrones.
Un átomo de oxígeno y un átomo de oxígeno se unen compartiendo electrones.
Dos átomos de hidrógeno y dos átomos de oxígeno forman una molécula de agua.
Desarrollo

1. Responda.
- ¿Cuántos electrones de valencia necesita el hidrógeno para ser estable?
- ¿Cuántos electrones de valencia necesita el oxígeno para ser estable?
2. Presente las respuestas de la actividad 1 en un cartel. Puede elaborar una tabla como esta para responder las preguntas planteadas anteriormente.
| Elemento | Estructura de Lewis | Electrones que necesita para ser estable |
| Hidrógeno | H | -1 |
| Oxígeno | -2 |
Nuevos aprendizajes
Los electrones de valencia suelen expresarse con un signo positivo o negativo, según el comportamiento del átomo en la reacción química. En ese caso, suele llamarse número de oxidación.
Las reglas generales para encontrar números de oxidación son:
- Un elemento libre/no combinado tiene número de oxidación cero.
- El oxígeno actúa con número de oxidación –2, con excepción de los peróxidos (O2)2, donde actúa con –1.
- El número de oxidación del hidrógeno es +1, excepto en los hidruros metálicos, donde es –1.
- El número de oxidación del flúor es siempre –1.
- Cuando los elementos de los grupos 15, 16 y 17 forman combinaciones binarias, usan el número de oxidación más bajo.
- Los elementos de los grupos 1, 2 y 3 siempre tienen estado de oxidación 1+, 2+ y 3+ respectivamente.
- En toda molécula, la suma algebraica de los números de oxidación debe ser cero. Por ejemplo, en el dióxido de carbono (CO2), el carbono actúa con número de oxidación +4 y el oxígeno actúa con –2.
+4 –4 =0
+4 _2
C1 O2
- Busque otros ejemplos.
Cierre
Ejercicios del tema

1. Identifique el número de oxidación del elemento que se indica en los siguientes compuestos.
- H2SO4; del azufre en el ácido sulfúrico.
- Na2O; del sodio en el óxido de disodio.
- CH4; del carbono en el metano.
- HCl; del hidrógeno en el cloruro de hidrógeno.
2. Forme compuestos según los números de oxidación de los elementos.
| Fósforo | Bromo | Azufre | |
| Sodio | |||
| Calcio | |||
| Oro |