Sesión 31, Segundo Grado – Ciencias Naturales
| Guías metodológicas para el docente de Ciclo Básico/Ciencias Naturales/Segundo Grado/Sesión 31 | |
|---|---|
| (Selecciona [Contraer] para reducir el recuadro, [Expandir] para ver contenido no mostrado). | |
| Autor | Ministerio de Educación de Guatemala |
| Área | Ciencias Naturales |
| Nivel y/o grado | Básico 2do grado |
| Competencia | |
| Indicador | |
| Saber declarativo | |
| Tipo de licencia | Derechos reservados con copia libre |
| Formato | HTML; PDF |
| Responsable de curación | Editor |
| Última actualización | 2020/06/20 |
Por favor, califica el recurso solo si lo has revisado y/o o usado.
Introducción[editar | editar código]
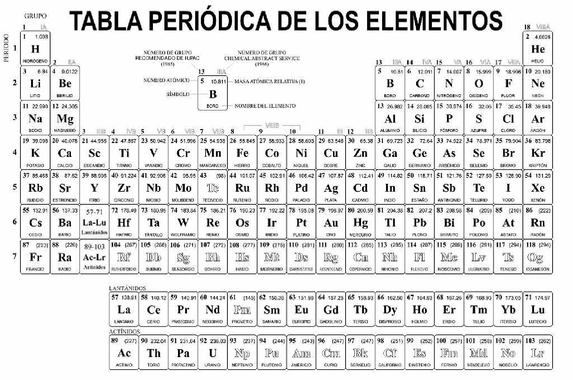
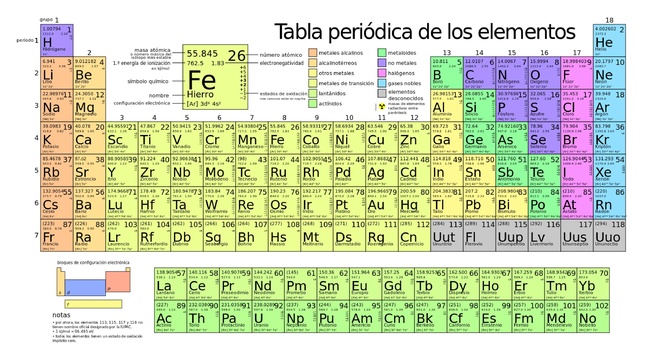
En el campo de la química, la tabla periódica toma relevancia por ser una herramienta que contiene información de los elementos presentes en el Universo.
Los elementos se encuentran ordenados en la tabla periódica en orden creciente de sus números atómicos y clasificados de acuerdo a la similitud existente entre sus propiedades físicas y químicas.
Recursos didácticos[editar | editar código]
- Pizarra
- marcadores
- diario de clase
- tabla periódica de los elementos
- crayones de diferentes colores
Inicio[editar | editar código]
Pregunte a los estudiantes de qué manera clasifican su ropa. Escuche atentamente cada clasificación que hacen sus estudiantes: por color, por uso (formal, casual, deportivo, para dormir...). Pregunte a los estudiantes si es importante clasificar la ropa y por qué.
Concluya esta actividad dejando clara la importancia de hacer clasificaciones.
Prepare con antelación una tabla periódica de tamaño suficiente para ser visible para sus estudiantes.
Muestre la tabla periódica a los estudiantes y solicite que de manera voluntaria se levanten de su escritorio a señalar su elemento favorito y que compartan con el resto del grupo por qué razón es su elemento favorito. De ser posible solicite que den algunas características de él.
Concluya la actividad señalando la importancia de que alguien haya clasificado y ordenado los elementos en la tabla periódica.
Trate de encausar todos los comentarios que los estudiantes hagan acerca de la clasificación y orden de su ropa y aproveche para destacar el orden como una cualidad necesaria en todos los aspectos de nuestra vida.
Desarrollo[editar | editar código]
Solicite a los estudiantes que anoten en su diario de clase: “tabla periódica”.
- Por medio de una lluvia de ideas formen una definición sencilla de la tabla periódica y su importancia.
- Solicite que cada quien anote en su diario de clase esa definición.
Entregue a cada estudiante una tabla periódica sin color y solicite que la coloreen de acuerdo a la clasificación que se haga de los elementos. En este enlace encontrará una versión de la tabla periódica que puede reproducir.
- Indique primero la clasificación general de los elementos en metales, no metales y metaloides y las características físicas y químicas de cada grupo.
- Solicite a los estudiantes que ubiquen en su tabla periódica los metales alcalinos y que los coloreen de color verde, (exceptuando el hidrógeno). Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son metales, tiene un electrón en su último nivel de energía, por lo que suelen formar cationes (+1); son todos brillantes, blandos y muy reactivos; son buenos conductores de calor y de electricidad; reaccionan de inmediato con el agua, oxígeno y otras sustancias químicas; y nunca se les encuentra como elementos libres (no combinados) en la naturaleza.
- Solicite a los estudiantes que ubiquen en su tabla periódica los metales alcalinotérreos y que los coloreen de color naranja. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son más duros que los metales alcalinos; tienen brillo y son buenos conductores eléctricos; son menos reactivos que los alcalinos; son buenos agentes reductores y forman compuestos iónicos. Todos ellos tienen dos electrones en su capa más externa por lo que suelen formar cationes (+2).
- Solicite a los estudiantes que ubiquen en su tabla periódica a la familia del boro y que los coloreen de color gris. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: tienen tres electrones en su capa más externa por lo que suelen formar cationes (+3). El boro, que es el elemento que encabeza esta familia, es un metaloide. Los otros elementos que comprenden este grupo son: aluminio(Al), galio (Ga), indio (In) y talio (Tl).
- Solicite a los estudiantes que ubiquen en su tabla periódica a la familia del carbono y que los coloreen de color azul. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: cada uno de los elementos de este grupo tiene 4 electrones en su capa más externa. En la mayoría de los casos, los elementos comparten sus electrones; la tendencia a perder electrones aumenta a medida que el tamaño del átomo aumenta. El carbono es un no metal que forma iones negativos bajo forma de carburos (4-).
- Solicite a los estudiantes que ubiquen en su tabla periódica a la familia del nitrógeno y que los coloreen de color rosa. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son elementos que tienen 5 electrones en su capa externa por lo que suelen formar aniones (-3). Sus compuestos pueden ser transparentes, pueden conducir electricidad cuando se calientan, y los compuestos tienden a ser estables y potencialmente tóxicos.
- Solicite a los estudiantes que ubiquen en su tabla periódica a los calcógenos y que los coloreen de color rojo. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos. Son elementos que tienen 6 electrones en su capa externa, por lo que suelen formar aniones (-2). La reactividad de estos elementos varía desde el oxígeno no metálico y muy electronegativo, hasta el polonio metálico. El oxígeno presenta unas propiedades muy distintas de los otros elementos del grupo, pues su diferente reactividad nace del pequeño tamaño del oxígeno, que lo hace muy oxidante y, por tanto, muy reactivo.
- Solicite a los estudiantes que ubiquen en su tabla periódica a los halógenos y que los coloreen de color rojo celeste. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son elementos que tienen 7 electrones en su capa externa, por lo que suelen formar aniones (-1). En estado natural se encuentran como moléculas diatómicas químicamente activas. En su mayoría son gaseosos, son muy reactivos y electronegativos.
- Solicite a los estudiantes que ubiquen en su tabla periódica a los gases nobles y que los coloreen de color violeta. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son elementos que tienen su último nivel de energía completo (8 electrones, octeto completo), por lo que son poco reactivos y algunos los llaman gases inertes. Son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja.
- Solicite a los estudiantes que ubiquen en su tabla periódica a los metales de transición y que los coloreen de color amarillo. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: son cuarenta elementos químicos comprendidos del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. El nombre de “transición” proviene de la característica que presentan estos elementos de poder ser estables por sí mismos sin necesidad de una reacción con otro elemento.
- Solicite a los estudiantes que ubiquen en su tabla periódica a los elementos de transición interna y que los coloreen de color café. Mientras ellos los colorean indique algunas de las características físicas y químicas de estos elementos: están situados en los bloques d y f de la tabla periódica. Se componen por los lantánidos y actínidos, en los cuales se comienza a llenar un orbital f. Se consideran también de transición, pero para distinguirlos de los del bloque d (de transición o de transición externa) se les suele denominar elementos de transición interna o tierras raras.
- Solicite a los estudiantes que elaboren una tabla que contenga la nomenclatura o código que utilizaron para colorear la tabla periódica.
| Verde | Metales alcalinos |
| Naranja | Metales alcalinotérreos |
| Gris | Familia del boro |
| Azul | Familia del carbono |
| Rosa | Familia del nitrógeno |
| Rojo | Calcógenos o anfígenos |
| Celeste | Halógenos |
| Violeta | Gases nobles |
| Amarillo | Metales de transición |
| Café | Elementos de transición interna |
Escriba en la pizarra el enunciado de la Ley Periódica: “las propiedades físicas y químicas de los elementos son funciones de las configuraciones electrónicas de sus átomos, las cuales varían periódicamente al aumentar el número atómico”.
- Explique a los estudiantes la manera en que surgió esta ley y cómo establece que las propiedades físicas y químicas de los elementos químicos tienden a repetirse de forma sistemática conforme aumenta el número atómico.
- De algunos ejemplos de elementos que se encuentran agrupados cerca y de cómo sus propiedades tanto físicas como químicas se asemejan.
Explique que las diferencias tanto físicas como químicas se deben a la distribución de los electrones dentro del átomo, denominada configuración electrónica. Indique a los estudiantes en qué parte de la tabla periódica se encuentra ubicada la configuración electrónica y la información que ésta nos brinda:
Realice con los estudiantes ejercicios relacionados con la configuración electrónica, en los que ellos sean capaces de indicar: nivel de energía, subnivel, electrones totales y electrones de valencia.
Trate de resolver cada duda que pueda surgir en cuanto a la información sobre cada familia de la tabla periódica.
Permita que los estudiantes tomen nota de las principales características de los grupos o familias de la tabla periódica.
Cerciórese que todos los estudiantes coloreen del color indicado cada grupo o familia de la tabla periódica.
Cierre[editar | editar código]
Al finalizar la sesión el estudiante:
- Establece la diferencia entre los distintos grupos o familias de la tabla periódica Describe las características de cada grupo o familia de la tabla periódica. Comprende la razón por la cual los elementos se encuentran ordenados de esa manera en la tabla periódica.
- Establece la organización de los electrones dentro de un átomo por medio de la configuración electrónica. Invite a los estudiantes a responder las siguientes preguntas de metacognición.
- ¿Cómo puedo mejorar?
- ¿Qué me ha resultado fácil, difícil, novedoso?
- ¿Cómo lo he aprendido?
- ¿Qué he aprendido?
Anexo: Tabla periódica de los elementos[editar | editar código]
Versión para impresión (blanco y negro)[editar | editar código]
Versión para impresión (color)[editar | editar código]
Versión vinculada a Wikipedia[editar | editar código]
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Bloque | s | d | p | |||||||||||||||
| ↓Período | ·El helio pertenece al bloque s | |||||||||||||||||
| 1 | 1 H |
2 He· | ||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 6 | 55 Cs |
56 Ba |
57-71 * |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89-103 ** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
| Bloque | f | d | |||||||||||||||
| * | Lantánidos | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
|
| ** | Actínidos | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
|
| Leyenda | Estado de agregación de la materia a 0°C y 1 atm (Según el color del número atómico) | ||||
| 1 H |
<- Número atómico | Rojo | Azul | Negro | Gris |
| <- Símbolo químico | Gaseoso | Líquido | Sólido | Desconocido | |
| Metales | Metaloides | No metales | |||||||
| Alcalinos | Alcalino- térreos |
Lantánidos | Metales de transición |
Otros metales |
Otros no metales |
Halógenos | Gases nobles | ||
| Actínidos | |||||||||
Para una versión más detallada de la tabla periódica con hipertexto, consúltese Anexo:Tabla periódica en Wikipedia.
Clave
| ||||||||||||||||||||
|
| |||||||||||||||||||
Notas[editar | editar código]
Es un documento funcional, generalmente breve, que sirve para comunicarse por escrito en situaciones de la vida cotidiana.