Tema 2. Tabla periódica de los elementos

Inicio[editar | editar código]

Indicador de logro
Describe la organización y características representadas en la tabla periódica de los elementos.
1. Identifique los usos de sustancias químicas representados en las imágenes y los que no.
Coméntelo en grupo.
Aluminio
Mercurio
Oxígeno
Fósforo
Cobre
Helio
- Responda. ¿Para qué otros usos funcionan estas sustancias químicas?
2. Realice un cuadro comparativo que describa las similitudes y diferencias entre las sustancias dadas en la actividad 1.
3. Observe cuál es la composición química de estos elementos.
- Ubíquelos en una tabla periódica de los elementos que tenga impresa o en formato digital.
|
Cobre Cu 29 |
Fósforo P 15 |
Helio He 2 |
Aluminio Al 13 |
Mercurio Hg 80 |
Oxígeno O 8 |
Desarrollo[editar | editar código]

1. Identifique los elementos químicos de los objetos descritos a continuación.
Anillo de oro
Barra de azufre
Alambre de estaño
El grafito de un lápiz
Clavo de hierro
Una lámpara de neón
2. Realice un glosario con los siguientes términos: radio atómico, energía de ionización, afinidad electrónica y electronegatividad.
- Agregue otros que considere necesarios.
3. Presente un elemento de la tabla periódica. Explique toda la información que contiene.
- Símbolo
- Número atómico
- Número de masa atómica
- Electronegatividad
- Propiedades físicas
- Propiedades químicas
- Abundancia
- Obtención
- Compuestos comunes
- Precauciones
4. Realice el siguiente esquema de la tabla periódica.
- El esquema se puede realizar con hojas cuadrícula.
Nuevos aprendizajes[editar | editar código]
La tabla periódica[editar | editar código]
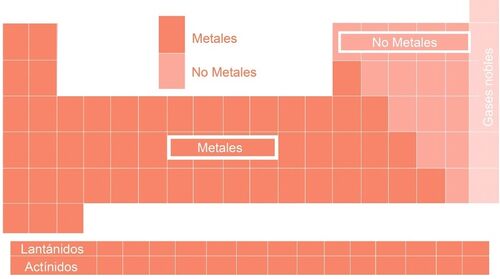
La tabla periódica moderna consta de 118 elementos ordenados en periodos y en grupos. Los periodos son las filas. En cada periodo se encuentran los elementos ordenados según el número de protones de su núcleo o número atómico (Z). Los grupos o familias son las columnas. Se encuentran divididos en dos subgrupos: A y B.
Los elementos químicos son las sustancias más puras y simples de la materia. Tienen diferentes propiedades. Los símbolos químicos son abreviaciones o signos que se utilizan para identificar los elementos y compuestos químicos.
Esta clasificación los divide en:
Metales
- Poseen brillo metálico.
- Son sólidos a temperatura ambiente (con excepción del mercurio).
- Son buenos conductores del calor y de la electricidad.
- Son dúctiles y maleables.
- Son electropositivos.
No metales
- No poseen brillo metálico.
- Pueden ser sólidos, líquidos o gases, en temperatura ambiente.
- No son buenos conductores del calor ni de la electricidad.
- Son frágiles.
- Son electronegativos.
Algunos no metales son llamados gases nobles, raros o inertes. En temperatura ambiente, son gaseosos y estables.
Los elementos químicos tienen propiedades que se repiten con intervalos más o menos regulares.
Con estas propiedades periódicas se puede determinar el comportamiento de los elementos, el cual se relaciona con la posición que ocupan en la tabla periódica.
Algunas de estas propiedades son:
Radio atómico
Afinidad electrónica
Punto de fusión
Energía de ionización
Electronegatividad
El radio atómico
Es la distancia que existe entre el núcleo y la capa de valencia. En un mismo periodo, este disminuye de izquierda a derecha. Esto se debe porque, al haber más electrones y protones, las fuerzas de atracción entre el núcleo y los electrones son más fuertes, situación que provoca un acercamiento de los niveles de energía. En un grupo/columna, el radio atómico aumenta en proporción directa con el número del periodo, que coincide con la cantidad de niveles de energía de los elementos.
La electronegatividad
Es la tendencia que tienen los átomos a ganar electrones durante las reacciones químicas. A medida que aumenta el número atómico (Z), la electronegatividad disminuye en los grupos/columna y aumenta en los periodos. Aumenta de abajo hacia arriba y de izquierda a derecha. Los átomos de elementos menos electronegativos donan sus electrones a los más electronegativos.
El radio iónico
Es el radio que tiene un átomo cuando ha perdido o ganado electrones, convirtiéndose en ion.
Cierre[editar | editar código]
Ejercicios del tema[editar | editar código]

1. Identifique, con ayuda de una tabla periódica impresa, los siguientes elementos.
- Descríbalos en el cuaderno.
Elementos metálicos
Elementos no metálicos
El estado de cada elemento
2. Busquen un modelo de tabla periódica en el enlace del recuadro. Elaboren una tabla en cartulinas de colores.
- Luego, analicen en grupo los siguientes esquemas relacionados con información importante que se localiza en la tabla periódica.
| Familia IA | Alcalinos |
| Familia IIA | Alcalinotérreos |
| Familia IIIA | Familia del boro |
| Familia IVA | Familia del carbono |
| Familia VA | Familia del nitrógeno |
| Familia VIA | Calcógenos |
| Familia VIIA | Halógenos |
| Familia VIIIA | Gases nobles |
| https://es.wikipedia.org/wiki/Tabla_peri%C3%B3dica_de_los_elementos#/media/Archivo:Periodic_table_large-esupdated-2018.svg. | |
Grupos
Grupo A: columnas 1, 2, 13, 14, 15, 16, 17 y 18.
Grupo B: columnas 3, 4, 5, 6, 7, 8, 9, 10, 11 y 12.
3. Respondan según el análisis que realizaron.
- ¿Cuántos periodos tiene la tabla periódica?
- ¿Cuántos elementos componen el primer periodo?
- ¿Cuántos grupos tiene la tabla periódica?
- Si el grupo B incluye las columnas de la 3 a la 12, identifíquelos en la estructura de la tabla periódica como metales de transición.
4. Analice los siguientes aspectos.
- Según la condición dada de la electronegatividad, ¿cuál es el elemento más electronegativo y cuál es el más electropositivo?
- ¿Qué diferencia existe entre el radio atómico y el radio iónico?
5. Observe una tabla periódica impresa o en digital y cuente su cantidad de grupos y periodos.
- ¿Contó 18 grupos y 7 periodos? Si no fue así, revíselo. Tome en cuenta la siguiente información: lea los periodos como si fueran las filas. El número atómico en los periodos debe ir en aumento.
6. Escriba los elementos que se encuentran en el periodo 1, incluya su número atómico (Z).
7. Escriba los elementos que se encuentran en el periodo 2, incluya su número atómico (Z).
8. Complete la siguiente información, en su cuaderno.
- El periodo 3 tiene ________ elementos.
- El periodo 4 tiene ________ elementos.
- El periodo 5 tiene ________ elementos.
- El periodo 6 tiene ________ elementos.
- En el lugar 57 (lantano) hay un conjunto de elementos con propiedades similares llamados lantánidos.
- El periodo 7 tiene ________ elementos, incluye el grupo de los actínidos.
9. Elija cinco elementos de la tabla periódica que le resulten familiares o conocidos:
- a. Escriba su símbolo, su nombre, número atómico (Z) y su número másico (A).
- b. Determine la cantidad de protones, neutrones y electrones de cada uno.
- c. Escriba dos elementos con las siguientes características, según lo establece la tabla periódica:
Familia VA
Periodo 6
10. Investigue dos elementos de la tabla periódica que forman parte del cuerpo humano y dos elementos que actualmente sean motivo de contaminación.
11. Realice esquemas de la tabla periódica para ejemplificar los siguientes aspectos.
- Aumento y disminución de la electronegatividad.
- Aumento y disminución del radio atómico.
Espacio vital en el que se desarrolla el ser humano. Conjunto de estímulos que condicionan al ser humano desde el momento mismo de su concepción.